王思思 谢双双 孟玥秀 张翔云 刘云春 王玲玲 王艳飞
(河北北方学院附属第一医院 1.妇产科;
2.新生儿科,河北张家口 075000)
宫内炎症是引起早产儿脑损伤的主要致病因素,可导致脑室周围白质软化坏死、神经元凋亡等病理现象,造成早产儿脑性瘫痪、视听及语言障碍、认知能力下降等神经系统后遗症[1-2]。小胶质细胞激活引发的炎症级联反应和细胞焦亡是宫内感染造成早产儿脑损伤的主要机制,控制宫内感染引发的炎症和小胶质细胞焦亡是防治早产儿脑损伤的关键[3-4]。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是机体主要的抗氧化分子,在各种脑损伤疾病的发生机制中起到重要调控作用,上调Nrf2可通过减轻神经炎症而抑制神经元死亡[5],还可抵抗脂多糖诱导的母婴炎症,防治宫内炎症引起的早产和围生期脑损伤[6],由此可知,Nrf2是防治宫内炎症所致早产脑损伤的重要靶点。
灯盏花素是从灯盏花中提取的一类总黄酮,有抗菌消炎、抗血栓、抗氧化、清除自由基的作用,在临床常用于脑梗死、冠心病等心脑血管疾病的治疗,可明显减轻腹腔镜全子宫切除术患者围术期应激反应及炎症反应,促进患者术后恢复[7]。灯盏花素还可通过激活Nrf2信号通路下调炎性因子白细胞介素(interleukin,IL)-1β、IL-6水平,从而抑制大鼠液压冲击脑损伤后脑组织炎性损伤[8]。由此推测灯盏花素可能通过激活Nrf2信号通路而抑制宫内炎症所致早产大鼠脑损伤与小胶质细胞焦亡。
本文以灯盏花素处理宫内炎症致早产脑损伤模型大鼠,探究灯盏花素是否可通过其抗炎作用减轻宫内炎症所致早产大鼠脑损伤,以Nrf2抑制剂(ML385)和灯盏花素联合处理宫内炎症致早产脑损伤模型大鼠,检测ML385是否可逆转灯盏花素对宫内炎症致早产大鼠脑损伤的保护作用,进而探究灯盏花素对宫内炎症致早产大鼠脑损伤的保护作用机制。
SPF级Sprague-Dawley大鼠购自山西医科大学实验动物中心,生产许可证号SCXK(晋)2019-0007。雄性28只,约7周龄,体重240~270 g;
雌性56只,约7周龄,体重190~220 g,均在本院屏障环境动物房中心适应饲养,1周后用于实验,饲养环境温度为(24±1)℃,湿度为44%±5%,昼夜时长12 h∶12 h。
注射用灯盏花素购自湖南恒生制药股份有限公司,ML385、脂多糖、兔源抗大鼠血红素加氧酶-1(heme oxygenase-1,HO-1)一抗购自北京索莱宝科技有限公司,苏木精-伊红(hematoxylineosin,HE)染色试剂盒、免疫荧光染色试剂盒-Alexa Fluor 488标记的抗小鼠二抗、免疫荧光染色试剂盒-Alexa Fluor 555标记的抗兔二抗、大鼠IL-1β酶联免疫吸附(ELISA)试剂盒、RIPA裂解液、山羊抗兔二抗、兔源抗大鼠核苷酸结合寡聚化结构域样受体蛋白 3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)一抗、兔源抗大鼠Nrf2一抗、兔源抗大鼠β-肌动蛋白(β-actin)一抗购自上海碧云天生物技术有限公司,兔源抗大鼠半胱氨酸天冬氨酸蛋白酶-1(caspase-1)一抗、小鼠源抗大鼠离子钙接头蛋白分子-1(ionized calcium binding adaptor molecule-1,IBA-1)一抗、兔源抗大鼠NLRP3一抗购自美国Abcam公司,BCA法总蛋白定量测定试剂盒、IL-6 ELISA试剂盒、IL-8 ELISA试剂盒购自南京建成生物工程研究所,MF-53N型倒置荧光显微镜购自苏州阿尔法生物实验器材有限公司,FlexA-200型全波长酶标仪购自杭州奥盛仪器有限公司,E-Gel Imager型凝胶成像系统购自广州道一科学技术有限公司。
制备宫内炎症致早产脑损伤大鼠模型[9]:将雄雌大鼠以1∶2的比例合笼,检查阴栓选出受孕成功的雌鼠,记为妊娠第1天,于孕鼠妊娠第16天腹腔内注射350 μg/kg脂多糖,连续注射2 d至妊娠第17天结束,孕期≤21 d表明早产造模成功[9]。将早产造模成功的孕鼠随机分为模型组、灯盏花素低剂量(45 mg/kg)组、灯盏花素高剂量(90 mg/kg) 组[8]、灯盏花素高剂量 (90 mg/kg)+ML385 (30 mg/kg) 组[10],每组10只孕鼠;
再随机选取10只孕鼠腹腔内注射等量0.9%氯化钠溶液作为对照组。
用0.9%氯化钠溶液将灯盏花素和ML385配制成浓度为4.5、9 mg/mL的灯盏花素溶液,9 mg/mL的灯盏花素和3 mg/mL的ML385混合药液,各组孕鼠于妊娠第17天给药(注射脂多糖后)。灯盏花素低剂量组、灯盏花素高剂量组孕鼠分别以10 mL/kg的剂量腹腔内注射4.5、9 mg/mL的灯盏花素,使灯盏花素的剂量分别为45 mg/kg、90 mg/kg[8];
灯盏花素高剂量+ML385组孕鼠以10 mL/kg的剂量腹腔内注射9 mg/mL的灯盏花素和3 mg/mL的ML385混合药液,使灯盏花素和ML385[10]的剂量分别为90 mg/kg、30 mg/kg;
模型组和对照组孕鼠以10 mL/kg的剂量腹腔内注射0.9%氯化钠溶液,每天早上9∶00注射1次,共注射2 d。
每组的10只孕鼠生产后,随机自每组所有存活仔鼠中各选出10只,于出生后给药(每天给药后送回母鼠旁喂养)。灯盏花素低剂量组、灯盏花素高剂量组仔鼠分别腹腔内注射45 mg/kg、90 mg/kg的灯盏花素;
灯盏花素高剂量+ML385组仔鼠腹腔内注射90 mg/kg灯盏花素和30 mg/kg的ML385;
模型组和对照组仔鼠以10 mL/kg的剂量腹腔内注射0.9%氯化钠溶液,每天早上9∶00注射1次,共注射7 d。
各组孕鼠生产后,计数每只孕鼠产出的仔鼠存活数,称量每只仔鼠体重,每组取平均值。异氟醚吸入麻醉产后的孕鼠,分离取出子宫和胎盘,清洗后浸没入冷冻切片所需的包埋剂中,以液氮迅速冷冻成块后,经专业技术员切片得到厚为4 μm的子宫和胎盘组织切片备用。
各组仔鼠于7 d给药结束后24 h,异氟醚吸入麻醉后脱颈椎处死,解剖分离出仔鼠大脑,剪下0.4 g左脑组织加入1 mL 0.9%氯化钠溶液研磨匀浆,取离心后的上清置于-80℃备用;
再次剪下0.4 g左脑组织加入1 mL RIPA裂解液研磨匀浆,100℃加热变性,以BCA法测定离心后上清中总蛋白浓度,置于-80℃备用;
剩余左脑组织清洗后浸没入冷冻切片包埋剂中,以液氮迅速冷冻成块后切片,得到厚为4 μm的脑组织切片,与1.4中子宫和胎盘组织切片一起在室温下静置复温,5 min后孵育冰丙酮固定15 min后取出,每只大鼠取子宫和胎盘组织切片3张,同时取具有脑室周围白质结构的脑组织切片3张,参照HE染色试剂盒说明进行,蒸馏水洗涤后在正常光下用显微镜观察并拍照。
取出1.4中各组仔鼠脑组织切片,室温下静置复温,5 min后孵育冰丙酮固定,分别孵育3%双氧水5 min后取出,3%牛血清白蛋白孵育2 h后取出,孵育IBA-1和NLRP3一抗(均1∶200稀释)过夜后洗涤,孵育Alexa Fluor 488标记的抗小鼠二抗(1∶100)和Alexa Fluor 555标记的抗兔二抗(1∶100)2 h,参照免疫荧光染色试剂盒说明书进行免疫荧光染色,避光洗涤后在荧光显微镜激发光下观察IBA-1与NLRP3共表达情况并拍照。Image J软件定量分析IBA-1与NLRP3共表达荧光强度,计算IBA-1与NLRP3共表达相对荧光强度=实验组IBA-1与NLRP3共表达荧光强度/对照组IBA-1与NLRP3共表达荧光强度。
将1.4中各组仔鼠脑组织样品液取出置于4℃解冻,取0.2 mL参照ELISA试剂盒说明测量其中IL-6、IL-8、IL-1β含量。
将1.5中测出总蛋白浓度的各组仔鼠脑组织样品液取出,置于4℃解冻后每组取出20 μg总蛋白,加入适量上样缓冲液并置于100℃水浴变性,通过跑电泳后湿转,将其按分子量大小分离转移至硝酸纤维素膜,根据目的蛋白分子量将其自膜上剪下后都浸没入3%牛血清白蛋白溶液中,室温孵育2 h封闭蛋白非特异位点,然后分别孵育相应的NLPR3、caspase-1、Nrf2、HO-1、β-actin一抗(分别按 1∶1 000、1∶3 000、1∶2 000、1∶2 000、1∶2 000稀释)、山羊抗兔二抗(1∶1 500),化学发光法显影后扫描出蛋白条带图片,运用图像处理软件Image J分析各蛋白灰度值,以β-actin为内参,计算目的蛋白相对表达量。
采用SPSS 25.0统计软件对数据进行统计学分析,计量资料采用均数±标准差(±s)表示;
多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05表示差异有统计学意义。
与对照组相比,模型组仔鼠存活数和体重降低(P<0.05);
与模型组相比,灯盏花素低、高剂量组仔鼠存活数和体重均升高(P<0.05);
与灯盏花素低剂量组相比,灯盏花素高剂量组仔鼠存活数和体重均升高(P<0.05)。与灯盏花素高剂量组相比,灯盏花素高剂量+ML385组仔鼠存活数和体重降低(P<0.05)。见表1。
表1 各组仔鼠存活数和体重 (± s,n=10)

表1 各组仔鼠存活数和体重 (± s,n=10)
注:a示与对照组比较,P<0.05;
b示与模型组比较,P<0.05;
c示与灯盏花素低剂量组比较,P<0.05;
d示与灯盏花素高剂量组比较,P<0.05。
images/BZ_93_1320_758_1755_817.pngimages/BZ_93_1320_876_1755_935.pngimages/BZ_93_1320_994_1755_1112.pngimages/BZ_93_1755_758_2034_817.pngimages/BZ_93_1755_876_2034_935.pngimages/BZ_93_1755_994_2034_1112.png组别对照组灯盏花素低剂量组灯盏花素高剂量+ML385组仔鼠存活数(只)11.2±1.7 8.3±0.9b 6.1±0.5d仔鼠体重(g)7.6±0.7 5.1±0.4a 6.2±0.4b 7.4±0.5b,c 5.4±0.4d 54.735<0.000
对照组孕鼠子宫及胎盘形态完好正常;
仔鼠脑室周围白质结构完好清晰,神经纤维排列致密且走向整齐,整体形态正常无损伤。模型组孕鼠子宫及胎盘组织产生病理损伤,子宫壁和胎盘组织中有大量中性粒细胞浸润且血管充血;
仔鼠脑组织产生病理损伤,脑室旁白质结构稀疏并出现软化灶,神经纤维紊乱、呈网状或条索状排列,神经元数目变少。与模型组相比,灯盏花素低、高剂量组孕鼠子宫、胎盘及仔鼠脑组织病理损伤均减轻;
与灯盏花素低剂量组相比,灯盏花素高剂量组孕鼠子宫、胎盘及仔鼠脑组织病理损伤进一步减轻;
与灯盏花素高剂量组相比,灯盏花素高剂量+ML385组孕鼠子宫、胎盘及仔鼠脑组织病理损伤加重。见图1~2。
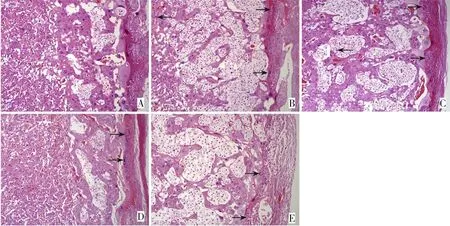
图1 各组孕鼠子宫及胎盘病理形态(苏木精-伊红染色,×200) A:对照组;
B:模型组;
C:灯盏花素低剂量组;
D:灯盏花素高剂量组;
E:灯盏花素高剂量+ML385组。对照组孕鼠子宫及胎盘形态完好正常;
模型组子宫壁和胎盘组织有大量中性粒细胞浸润且血管充血;
灯盏花素低剂量组子宫壁和胎盘组织有少量中性粒细胞浸润,血管充血轻微;
灯盏花素高剂量组子宫壁和胎盘组织有很少中性粒细胞浸润,血管几乎不充血;
灯盏花素高剂量+ML385组子宫壁和胎盘组织有大量中性粒细胞浸润且血管充血。箭头所指为炎性浸润。
对照组、模型组、灯盏花素低剂量组、灯盏花素高剂量组、灯盏花素高剂量+ML385组IBA-1与NLRP3共表达相对荧光强度分别为1.00±0、3.12±0.30、2.06±0.33、 1.29±0.32、2.91±0.35,组间比较差异有统计学意义(F=105.041,P<0.001)。与对照组相比,模型组仔鼠脑皮质产生严重小胶质细胞焦亡,IBA-1和NLRP3共表达相对荧光强度升高(P<0.05);
与模型组相比,灯盏花素低、高剂量组仔鼠脑皮质小胶质细胞焦亡均减轻,IBA-1和NLRP3共表达相对荧光强度降低(P<0.05);
与灯盏花素低剂量组相比,灯盏花素高剂量组仔鼠脑皮质小胶质细胞焦亡减轻,IBA-1和NLRP3共表达相对荧光强度降低(P<0.05);
与灯盏花素高剂量组相比,灯盏花素高剂量+ML385组仔鼠脑皮质小胶质细胞焦亡加重,IBA-1和NLRP3共表达相对荧光强度升高(P<0.05)。见图3。

图3 各组仔鼠脑皮质中IBA-1和NLRP3共表达情况(免疫荧光染色,×200) A:对照组;
B:模型组;
C:灯盏花素低剂量组;
D:灯盏花素高剂量组;
E:灯盏花素高剂量+ML385组。IBA-1在仔鼠脑皮质中呈现明亮的绿色荧光;
NLRP3在仔鼠脑皮质中呈现明亮的红色荧光;
DAPI标记仔鼠脑皮质细胞核染色,呈现蓝色荧光;
Merge为各组IBA-1、NLRP3和DAPI三者合成图,IBA-1和NLRP3共表达相对荧光强度越低,表明仔鼠脑皮质小胶质细胞焦亡越轻。
与对照组相比,模型组仔鼠脑组织中IL-6、IL-8及IL-1β水平升高(P<0.05);
与模型组相比,灯盏花素低、高剂量组仔鼠脑组织中IL-6、IL-8及IL-1β水平均降低(P<0.05);
与灯盏花素低剂量组相比,灯盏花素高剂量组仔鼠脑组织中IL-6、IL-8及IL-1β水平降低(P<0.05);
与灯盏花素高剂量组相比,灯盏花素高剂量+ML385组仔鼠脑组织中IL-6、IL-8及IL-1β水平升高(P<0.05)。见表2。
表2 各组仔鼠脑组织中IL-6、IL-8及IL-1β水平比较 (± s,n=10)

表2 各组仔鼠脑组织中IL-6、IL-8及IL-1β水平比较 (± s,n=10)
注:[IL-6]白细胞介素-6;
[IL-8]白细胞介素-8;
[IL-1β]白细胞介素-1β。a示与对照组比较,P<0.05;
b示与模型组比较,P<0.05;
c示与灯盏花素低剂量组比较,P<0.05;
d示与灯盏花素高剂量组比较,P<0.05。
images/BZ_95_273_2878_891_2932.pngimages/BZ_95_273_2985_891_3038.pngimages/BZ_95_273_3091_891_3197.pngimages/BZ_95_891_2878_1353_2932.pngimages/BZ_95_891_2985_1353_3038.pngimages/BZ_95_891_3091_1353_3197.pngimages/BZ_95_1353_2878_1816_2932.pngimages/BZ_95_1353_2985_1816_3038.pngimages/BZ_95_1353_3091_1816_3197.png组别对照组灯盏花素低剂量组灯盏花素高剂量+ML385组IL-6 (pg/g)74±10 178±20b 241±40d IL-8 (ng/g)215±34 628±51b 960±91d IL-1β (ng/g)197±32 835±87a 526±50b 214±46b,c 815±81d 242.669<0.001
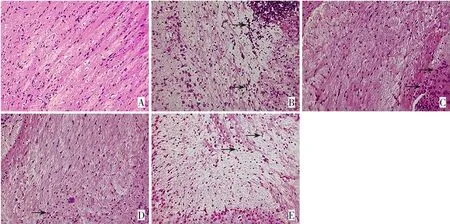
图2 各组仔鼠脑组织病理形态(苏木精-伊红染色,×200) A:对照组;
B:模型组;
C:灯盏花素低剂量组;
D:灯盏花素高剂量组;
E:灯盏花素高剂量+ML385组。对照组脑室旁白质结构完好清晰,神经纤维排列致密且走向整齐,整体形态正常;
模型组脑室旁白质结构稀疏并出现软化灶,神经纤维紊乱、呈网状或条索状排列,神经元数目变少;
灯盏花素低剂量组脑室旁白质结构稀疏程度减轻,软化灶减少,神经纤维紊乱减轻,神经元数目增多;
灯盏花素高剂量组脑室旁白质结构变得紧密,软化灶大大减少,神经纤维致密且走向整齐,神经元数目增多;
灯盏花素高剂量+ML385组脑室旁白质结构稀疏并出现软化灶,神经纤维紊乱、呈网状或条索状排列,神经元数目变少。箭头所指为炎性浸润。
与对照组相比,模型组仔鼠脑组织中NLPR3、caspase-1蛋白表达升高(P<0.05),Nrf2、HO-1蛋白表达降低(P<0.05);
与模型组相比,灯盏花素低、高剂量组仔鼠脑组织中NLPR3、caspase-1蛋白表达降低(P<0.05),Nrf2、HO-1蛋白表达升高(P<0.05);
与灯盏花素低剂量组相比,灯盏花素高剂量组仔鼠脑组织中NLPR3、caspase-1蛋白表达降低 (P<0.05),Nrf2、HO-1蛋白表达升高(P<0.05);
与灯盏花素高剂量组相比,灯盏花素高剂量+ML385组仔鼠脑组织中NLPR3、caspase-1蛋白表达升高(P<0.05),Nrf2、HO-1蛋白表达降低(P<0.05)。见图4、表3。

图4 各组仔鼠脑组织中NLPR3、caspase-1、Nrf2、HO-1蛋白表达条带图 A:对照组;
B:模型组;
C:灯盏花素低剂量组;
D:灯盏花素高剂量组;
E:灯盏花素高剂量+ML385组。
表3 各组仔鼠脑组织中NLPR3、caspase-1、Nrf2、HO-1蛋白相对表达水平比较 (± s,n=10)

表3 各组仔鼠脑组织中NLPR3、caspase-1、Nrf2、HO-1蛋白相对表达水平比较 (± s,n=10)
注:[NLPR3]核苷酸结合寡聚化结构域样受体蛋白3;
[caspase-1]半胱氨酸天冬氨酸蛋白酶-1;
[Nrf2]核因子E2相关因子2;
[HO-1]血红素加氧酶-1。a示与对照组比较,P<0.05;
b示与模型组比较,P<0.05;
c示与灯盏花素低剂量组比较,P<0.05;
d示与灯盏花素高剂量组比较,P<0.05。
images/BZ_96_273_1945_800_2008.pngimages/BZ_96_273_2067_800_2126.pngimages/BZ_96_273_2185_800_2244.pngimages/BZ_96_273_2303_800_2421.pngimages/BZ_96_800_1945_1184_2008.pngimages/BZ_96_800_2067_1184_2126.pngimages/BZ_96_800_2185_1184_2244.pngimages/BZ_96_800_2303_1184_2421.pngimages/BZ_96_1184_1945_1567_2008.pngimages/BZ_96_1184_2067_1567_2126.pngimages/BZ_96_1184_2185_1567_2244.pngimages/BZ_96_1184_2303_1567_2421.pngimages/BZ_96_1567_1945_1923_2008.pngimages/BZ_96_1567_2067_1923_2126.pngimages/BZ_96_1567_2185_1923_2244.pngimages/BZ_96_1567_2303_1923_2421.png对照组灯盏花素低剂量组灯盏花素高剂量+ML385组0.19±0.04 0.58±0.07b 0.86±0.09d 0.11±0.02 0.47±0.07b 0.81±0.10d 0.90±0.16 0.53±0.09b 0.36±0.06d HO-1 1.01±0.22 0.24±0.04a 0.57±0.08b 0.96±0.16b,c 0.29±0.05d 77.414<0.001
宫内炎症会导致早产儿脑损伤,不及时治疗可遗留运动、智力、精神等方面的神经系统症状,采取积极有效措施减轻因早产导致的脑损伤可减少小儿伤残的发生,有益于优生优育的实行[11-12]。小胶质细胞激活引起的细胞焦亡是神经炎症导致脑损伤的主要病理基础,NLRP3炎症小体激活是其中的关键事件,减轻NLRP3诱导的小胶质细胞焦亡,可减轻炎症反应导致的脑神经损伤[13],IBA-1是小胶质细胞的标记物,检测NLRP3和IBA-1的共表达情况可评测小胶质细胞激活引发的细胞焦亡水平[13-14]。本研究于妊娠第16天、第17天向孕鼠腹腔内注射350 μg/kg脂多糖构建宫内炎症致早产大鼠模型,结果显示脂多糖可增强促炎性细胞因子IL-6、IL-8及IL-1β表达,引发孕鼠宫内炎症及子宫、胎盘组织损伤,最终导致仔鼠脑组织产生病理损伤,造成仔鼠存活数和体重降低,揭示宫内炎症可造成孕鼠早产及仔鼠脑损伤。早产仔鼠脑皮质IBA-1和NLRP3共表达增强,脑组织中NLPR3、caspase-1蛋白表达水平升高,表明宫内炎症可导致仔鼠脑部小胶质细胞焦亡。
宫内感染能触发母婴炎症,并可诱导仔鼠神经系统炎症,造成早产大鼠髓鞘发育不良、神经元减少等脑室周围白质损伤[15]。控制并减轻宫内炎症是防治早产小鼠脑损伤的有效手段[16]。灯盏花素是具有显著抗炎作用的总黄酮类活性物质,临床中常用其注射液治疗颅脑损伤、脑梗死等神经系统疾病,灯盏花素联合吡拉西坦可有效降低血清炎症因子,改善中型颅脑损伤患者神经功能[17],还可联合阿加曲班减轻急性脑梗死患者神经功能缺损[18],抑制腹腔镜全子宫切除术患者围术期炎症及应激反应[7],本研究以灯盏花素处理孕鼠和仔鼠,可降低仔鼠脑组织中IL-6、IL-8、IL-1β水平及NLPR3、caspase-1蛋白表达,升高仔鼠存活数和体重,减弱仔鼠脑皮质IBA-1和NLRP3共表达,并减轻孕鼠子宫、胎盘组织及仔鼠脑组织病理损伤,表明灯盏花素可下调促炎因子表达,抑制孕鼠宫内及仔鼠脑组织炎症发生,减轻仔鼠脑组织病理损伤及小胶质细胞焦亡,促使仔鼠发育,改善孕鼠早产现象,最终对早产大鼠发挥脑保护作用。
Nrf2可通过调控活性氧自由基和炎性因子生成介导脑部神经炎症,激活Nrf2信号可显著抑制活性氧介导的炎症和神经元细胞凋亡,减轻缺血性卒中后脑损伤[19],还可促进抗氧化反应,下调促炎细胞因子表达,通过抗氧化和抗炎作用减轻氧自由基介导的早产儿脑损伤,对发育中大脑发挥神经保护作用[20]。另有研究显示灯盏花素可通过上调Nrf2通路减轻液压冲击所致脑部炎性损伤[8],因而推测激活Nrf2信号可能是灯盏花素抑制宫内炎症所致早产脑损伤大鼠小胶质细胞焦亡的作用机制。本研究结果显示,灯盏花素可提高宫内炎症致早产大鼠脑组织中Nrf2及HO-1蛋白表达,且高剂量灯盏花素作用更强,表明Nrf2信号参与灯盏花素对宫内炎症致早产大鼠脑损伤的保护作用。以灯盏花素高剂量和ML385联合处理孕鼠和仔鼠,相比灯盏花素高剂量单独处理,可降低仔鼠存活数和体重、仔鼠脑组织中Nrf2及HO-1蛋白表达水平,升高仔鼠脑组织中IL-6、IL-8、IL-1β水平及NLPR3、caspase-1蛋白表达水平,并增强仔鼠脑皮质IBA-1和NLRP3共表达,加重孕鼠子宫、胎盘组织及仔鼠脑组织病理损伤,表明ML385可减弱灯盏花素的抗炎作用,降低其对宫内炎症致早产大鼠脑组织炎症反应和小胶质细胞焦亡的抑制作用,最终逆转灯盏花素的脑保护作用,揭示灯盏花素抑制宫内炎症所致早产脑损伤大鼠小胶质细胞焦亡是通过激活Nrf2信号实现的。
综上所述,本研究表明灯盏花素可通过激活Nrf2信号而减轻宫内炎症,促使胎鼠存活,并抑制早产大鼠脑组织小胶质细胞焦亡和炎症反应,缓解脑损伤,促使Nrf2信号通路传导是其作用机制之一,本研究为宫内炎症致早产儿脑损伤的防治药物选择提供了实验依据和新思路。
猜你喜欢孕鼠花素灯盏灯盏乙素对OX-LDL损伤的RAW264.7细胞中PKC和TNF-α表达的影响昆明医科大学学报(2021年10期)2021-12-02黑暗中的灯盏都市(2019年6期)2019-09-10灯盏花素分散片溶出度检测方法的改进中成药(2018年10期)2018-10-26灯盏花素注射液对腹腔镜全子宫切除术患者围术期应激反应及炎症反应的影响中成药(2018年9期)2018-10-09HPLC法同时测定灯盏细辛注射液中10种成分中成药(2017年12期)2018-01-19叶酸对不良妊娠结局孕鼠脂质代谢的影响*山东第一医科大学(山东省医学科学院)学报(2017年5期)2017-06-15芒柄花素的现代研究进展山西中医药大学学报(2017年5期)2017-04-04胚胎干细胞对孕鼠缺血受损心肌的修复作用中国实验动物学报(2016年2期)2016-07-15制剂新技术在灯盏花素研发中的应用云南中医学院学报(2015年2期)2015-07-31胰岛胰岛素信号通路障碍在AT1-AA阳性孕鼠后代胰岛素抵抗中作用*中国病理生理杂志(2015年10期)2015-01-26扩展阅读文章
推荐阅读文章
老骥秘书网 https://www.round-online.com
Copyright © 2002-2018 . 老骥秘书网 版权所有