邢亨特,梁传财,王晨宇,邱 波
骨关节炎(osteoarthritis, OA)是一种慢性关节疾病,常伴随关节软骨退变、骨质改变和关节滑膜炎症等病理变化。传统观点认为性别、衰老、肥胖、关节创伤和遗传易感性等因素与OA的发生和发展紧密相关,但其确切致病因素现尚无定论[1]。近年,越来越多的研究证实了OA与代谢综合征有密切联系,因二者的核心都是慢性低度全身性炎症,有学者甚至认为OA可能属于代谢综合征的范畴[2]。代谢综合征被认为是导致动脉粥样硬化、心血管疾病和糖尿病的危险因素[3]。有研究显示,与普通人群相比,OA患者患动脉粥样硬化的风险更高,其中脂质代谢的改变可能发挥着关键作用[4]。有文献报道,OA患者的软骨细胞中存在特异性脂质沉积,而胆固醇的异常沉积能破坏细胞膜的结构和功能,导致细胞死亡[5]。还有研究显示,高胆固醇血症能触发软骨细胞的线粒体过度氧化应激,促进其凋亡和炎症反应。有细胞水平研究也发现,在外源性给予胆固醇后,可加速软骨细胞外基质的降解,严重影响关节软骨的质量[6-7]。可见,胆固醇在OA的发生和发展中发挥着重要作用,故调节软骨细胞内胆固醇含量可能延缓OA的进展。
目前,二甲双胍(MET)是治疗2型糖尿病的一线药物之一。随着研究的深入,发现MET除了降糖的作用外,在调节脂质代谢方面也发挥着出色的作用[8-9]。有研究发现,MET能通过降低乳腺癌MDA-MB-231细胞系中胆固醇含量,抑制癌细胞的生长和转移[10]。此外,还有研究显示MET可降低血液总胆固醇和低密度脂蛋白胆固醇水平,这可能是治疗动脉粥样硬化和2型糖尿病的有效策略[8]。可见,MET的降脂活性可能对多种疾病具有一定疗效,但其对OA的疗效鲜有报道。因此,本研究构造Wistar大鼠OA软骨细胞模型,分析MET对关节软骨细胞基质合成、降解及胆固醇合成通路相关基因表达的影响,探讨胆固醇对OA软骨细胞的作用机制,以期为OA发病机制研究提供新思路。
1.1主要仪器和试剂 qRT-PCR仪(美国ABI公司),紫外分析仪(北京君意有限公司),酶标仪(美国Thermofisher公司),倒置显微镜(广州明美科技有限公司),微量分光光度计(杭州奥胜仪器有限公司),Trizol(美国Amibon公司),兔多抗GAPDH(杭州贤至生物有限公司),兔多抗Ⅱ型胶原蛋白(ColⅡ)、兔多抗SREBP-2(美国Affinity公司),兔多抗基质金属蛋白酶-13(MMP-13)(武汉三鹰生物技术有限公司),兔多抗HMGCR(英国Abcam公司),白细胞介素-1β(IL-1β)(美国Pepeotech公司),MET(上海阿拉丁公司),CCK-8细胞增殖及毒性检测试剂盒(上海皓元生物医药科技有限公司),总胆固醇(TCH)测定试剂盒(南京建成生物科技有限公司)。
1.2Wistar大鼠关节软骨细胞培养和处理 在无菌环境下处死Wistar大鼠,取双侧膝关节软骨组织,剪刀剪碎,用0.1%胰蛋白酶浸泡60 min,在培养箱中过夜;
收集消化后的细胞,重悬在软骨细胞培养基中培养;
然后将培养基中的软骨细胞置于细胞培养箱中传代,后续实验采用第二代软骨细胞。
1.3细胞存活率检测 采用CCK-8法进行细胞存活率检测。取生长状态良好的软骨细胞以5×103个接种于细胞培养96孔板中,在37 ℃、5% CO2培养箱中过夜;
用IL-1β(1 ng/ml)和不同浓度MET(5、10、15 mmol/L)对细胞处理24 h。每孔加入10 μl CCK-8反应液,37 ℃培养2 h;用酶标仪测定吸光度(OD)值,波长450 nm,计算细胞存活率。
1.4关节软骨细胞mRNA表达检测 采用TRIzol法提取软骨细胞总RNA。用cDNA合成试剂盒合成互补链DNA;
采用SYBR Green Marter Mix 实时定量PCR技术检测目的基因的mRNA表达,具体操作步骤按照试剂盒说明书进行。采用ABI Quant Studio6 对cDNA进行定量分析。热循环条件:95 ℃孵育10 min,95 ℃变性15 s,共40个扩增循环,60 ℃退火延伸。以GAPDH为内参,比较定量采用2-ΔΔCt法。引物序列(5"-3"):GAPDH上游ACAGCAACAGGGTGGTGGAC,下游TTTGAGGGTGCAGCGAACTT,产物253 bp;
MMP-13上游ACCAGAGAAGTGTGACCCAG,下游CTCGGGATGGATGCTCGTAT,产物191 bp;
ColⅡ上游TGACTTTCCTCCGTCTACTGTC,下游AGGTCTTCTGTGATCGGTACTC,产物249 bp。
1.5关节软骨细胞蛋白提取 用预冷的PBS洗涤3次软骨细胞,然后用RIPA裂解液溶解细胞,按1 ml裂解液加10 μl PMSF(100 mmol/L),摇匀置于冰上。裂解完后将细胞碎片和裂解液移至1.5 ml离心管中,离心后取上清于离心管中放置于-20℃保存。用于后续Western Blot法检测原代软骨细胞目的基因的表达。
1.6关节软骨细胞TCH含量 采用TCH测定试剂盒检测软骨细胞TCH含量。通过裂解和离心收集细胞,然后根据试剂盒说明书,在96孔板上操作,并使用酶标仪测量每个孔的OD值,波长510 nm。
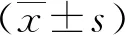
2.1关节软骨细胞CCK-8法检测结果 在用IL-1β制备的OA软骨细胞模型中分别加入浓度为5、10、15 mmol/L的MET处理24 h后,进行CCK-8法细胞增殖分化活性检测,发现在MET浓度为10 mmol/L时细胞增殖分化活性较佳,见图1,后续实验采用浓度为10 mmol/L MET进行。

图1 Wistar大鼠关节软骨细胞CCK-8法检测结果
2.2MET对关节软骨细胞基质合成和降解的影响 与正常软骨细胞比较,OA软骨细胞ColⅡ mRNA显著降低,而MMP-13 mRNA则显著升高(P<0.05)。与OA软骨细胞比较,经10 mmol/L MET干预后的OA软骨细胞Col Ⅱ mRNA明显升高,MMP-13 mRNA显著降低(P<0.05)。见图2。

图2 MET对Wistar大鼠关节软骨细胞基质合成和降解的影响
2.3MET对关节软骨细胞胆固醇合成通路的影响 与正常软骨细胞比较,OA软骨细胞胆固醇调节元件结合蛋白-2(SREBP-2)和羟甲基戊二酸单酰辅酶A还原酶(HMGCR)蛋白明显升高(P<0.01)。与OA软骨细胞比较,经10 mmol/L MET处理后的OA软骨细胞SREBP-2和HMGCR蛋白显著降低(P<0.01)。见图3。
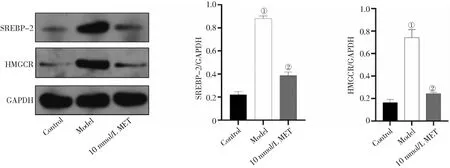
图3 MET对Wistar大鼠关节软骨细胞胆固醇合成通路的影响
2.4MET对关节软骨细胞TCH的影响 与正常软骨细胞比较,OA软骨细胞TCH明显升高(P<0.01)。与OA软骨细胞比较,经10 mmol/L MET处理后的OA软骨细胞TCH显著降低(P<0.01)。见图4。

图4 MET对Wistar大鼠关节软骨细胞TCH的影响
OA是导致老年患者慢性残疾的主要原因,其病因复杂多样,尚无定论。近年,越来越多的学者认为脂质代谢异常可能与OA的发展存在关联。有文献报道内分泌器官的脂肪含量增加被证明是关节异常负荷和脂肪因子、炎性因子过度产生的原因[11-12]。有研究显示胆固醇代谢失调与软骨细胞中异常脂肪堆积有关,从而导致OA表型产生[13]。还有文献报道在家族性高胆固醇血症患者关节内也能见到明显的胆固醇沉积,可能与手部OA发生密切相关[14]。因此,调节软骨细胞内异常胆固醇代谢可能对OA治疗发挥作用。
随着研究的不断深入,MET的诸多潜在作用被发现,它可能对多种疾病具有一定作用。在肌肉骨骼系统疾病中,FENG等[15]研究显示MET可能通过调节AMPK/mTOR信号通路,延缓软骨衰老和退化。还有研究发现,MET能减轻OA软骨细胞氧化应激、炎症反应和线粒体损伤;
此外,MET还能通过AMPK/SIRT1通路,调节软骨细胞自噬与凋亡之间的相互作用,抑制OA表型表达,抑制OA软骨细胞外基质降解,保护关节软骨[16-17]。本研究结果显示,与正常软骨细胞比较,OA软骨细胞ColⅡmRNA显著降低,而MMP-13 mRNA和TCH显著升高;
与OA软骨细胞比较,经10 mmol/L MET处理后的OA软骨细胞Col Ⅱ mRNA明显升高,而MMP-13 mRNA和TCH显著降低。说明IL-1β诱导的OA软骨细胞TCH表达显著升高,而MET能有效降低OA软骨细胞内胆固醇含量,同时促进OA软骨细胞的ColⅡmRNA表达,抑制OA软骨细胞MMP-13 mRNA表达。提示MET能减少软骨细胞内TCH含量,促进软骨细胞基质合成,抑制基质降解,保护软骨。
胆固醇是细胞膜的重要成分,包括软骨细胞在内的多类细胞都能通过生物合成途径合成胆固醇,并且在其生物合成途径中与其他中间体一起调控信号分子[18]。有研究表明,胆固醇调节元件结合蛋白是调节脂质代谢的关键转录因子,其中SREBP-2参与激活胆固醇代谢和生物合成基因[7]。KOSTOPOULOU等[19]研究发现,miR-33a通过转化生长因子/Akt/SREBP-2途径调控OA软骨细胞中胆固醇的合成,并且HMGCR作为SREBP-2靶基因,在OA软骨细胞中表达是显著升高的。本研究结果显示,与正常软骨细胞比较,OA软骨细胞SREBP-2和HMGCR蛋白明显升高;
与OA软骨细胞比较,经10 mmol/L MET处理后的OA软骨细胞SREBP-2和HMGCR蛋白显著降低。说明MET能减少OA软骨细胞胆固醇合成通路中关键基因SREBP-2和HMGCR蛋白表达,结合胞内TCH表达的变化,提示MET可能通过减弱软骨细胞SREBP-2/HMGCR通路,抑制胞内胆固醇合成,减少胆固醇蓄积。可见,胆固醇合成异常可能是影响OA发生和发展的因素之一。
综上所述,MET能有效减少IL-1β诱导的Wistar大鼠OA软骨细胞中的胆固醇含量,同时能够减少关节软骨细胞外基质的降解,而这可能是通过抑制SREBP-2/HMGCR信号通路、减少胆固醇合成实现的。本研究有助于我们进一步认识胆固醇代谢与OA的关系,为OA的早期防治提供新的思路。然而,本研究尚未证明胆固醇流出通路对OA的影响,以及胆固醇合成与流出之间的相互关系,尚待进一步研究。
猜你喜欢软骨试剂盒胆固醇谈谈胆固醇保健医苑(2022年1期)2022-08-30降低胆固醇的药物(上)中老年保健(2022年3期)2022-08-24降低胆固醇的药物(下)中老年保健(2022年4期)2022-08-22带线锚钉缝合固定治疗髌骨软骨骨折的疗效昆明医科大学学报(2022年2期)2022-03-29SOX9在SD大鼠胚胎发育髁突软骨与胫骨生长板软骨中的时间表达研究昆明医科大学学报(2022年2期)2022-03-296种非洲猪瘟荧光PCR试剂盒对比试验湖南畜牧兽医(2021年6期)2022-01-24农药残留快速检测试剂盒的制备方法及其应用研究食品安全导刊(2021年21期)2021-08-304种非洲猪瘟核酸检测试剂盒性能比较分析猪业科学(2021年5期)2021-06-02两种小反刍兽疫病毒检测试剂盒的比较分析中国畜禽种业(2021年4期)2021-05-21胆固醇稍高可以不吃药吗等7题…饮食科学(2017年12期)2018-01-02扩展阅读文章
推荐阅读文章
老骥秘书网 https://www.round-online.com
Copyright © 2002-2018 . 老骥秘书网 版权所有