庄 蕾,苏建彬,王春华***,朱锦
(1江苏省南通市第二人民医院内分泌科,南通 226002;
2南通大学第二附属医院,江苏省南通市第一人民医院内分泌科;
3南京医科大学附属妇产医院,江苏省南京市妇幼保健院科技处)
在我国,糖尿病的患病人数正逐年增多,研究[1]表明,目前每10 个中国人中就有1 个是糖尿病患者。糖尿病肾病是糖尿病中最常见的微血管并发症[2],其主要特征为进行性蛋白尿和肾功能衰退,最终发展为终末期肾病[3]。虽然关于糖尿病肾病的发病机制尚未完全明确,但炎症被认为是糖尿病肾病发生发展的重要环节[4],此外,氧化应激、细胞凋亡[5]、糖代谢异常[6]等在内的病理过程也参与了糖尿病肾病的发生。糖代谢异常包括长期高血糖和长期血糖波动,2 型糖尿病患者的血糖调控主要由胰岛α、β 细胞参与,胰岛β 细胞分泌胰岛素降低血糖而胰岛α细胞分泌胰高血糖素升高血糖,两者互为抑制,互为影响。本研究对2 型糖尿病肾病的相关性因素进行研究,特别观察了胰岛α 细胞分泌的胰高血糖素在糖尿病肾病发生和发展中的变化,以期为糖尿病肾病的早期诊断和治疗提供基础理论指导。
1.1 研究对象 糖尿病肾病的诊断标准[7]为:(1)合并糖尿病视网膜病变;
(2)持续白蛋白尿,尿白蛋白/尿肌酐比值(urine albumin creatine ratio,UACR)>300 μg/mg,或尿白蛋白排泄率>200 μg/min,或尿蛋白定量>300 mg/d,或常规尿蛋白定量>0.5 g/d,早期可表现为微量白蛋白尿;
(3)临床和实验室检查排除其他肾脏或尿路疾病。早期糖尿病肾病期:持续微量白蛋白尿期,即UACR 持续处于30~300 μg/mg;
临床糖尿病肾病期:UACR>300 μg/mg。根据此标准选择2018 年1 月—2020 年7 月间在南通市第一人民医院、南通市第二人民医院内分泌科住院的早期糖尿病肾病期(AⅠ组)和临床糖尿病肾病期(AⅡ组)患者各50 例,另选择同期不合并糖尿病肾病2 型糖尿病患者50 例(B 组)为研究对象。纳入标准:(1)年龄18~65 岁;
(2)符合2020 年中国2 型糖尿病防治指南[8]中2 型糖尿病的诊断标准。排除标准:(1)继发性糖尿病、妊娠期糖尿病及1 型糖尿病;
(2)糖尿病酮症酸中毒、高糖高渗昏迷等糖尿病急性并发症;
(3)6 个月内有恶性高血压、心肌梗死、脑血管意外等危急重症病史者,恶性肿瘤晚期者;
(4)提示可能为糖尿病合并其他肾脏疾病的情况:无视网膜病变;
肾小球滤过率(estimated glomerular filtration rate,eGFR)迅速下降;
蛋白尿急剧增加或出现肾病综合征;
尿沉渣活动表现,有形成分增多;
合并其他系统疾病(如自身免疫病)的症状或体征;
血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体拮抗剂起始治疗后2~3 个月内,eGFR下降>30%;
肾功能异常,但无明显蛋白尿;
肾病综合征持续时间>1 年,但肾功能正常;
(5)有精神疾病或智力障碍不能进行有效沟通者。最终因病例资料不完整退出研究AⅠ组3 例、AⅡ组4 例。本研究通过南通市第一人民医院、南通市第二人民医院伦理委员会审批(2019KS070,2018KS038)。
1.2 观察指标 (1)收集患者的临床资料,包括年龄、身高、体质量、腰围、臀围、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、糖尿病病程、性别、吸烟史、饮酒史、药物服用史、家族史等,计算体质量指数(body mass index,BMI)。(2)实验室指标:①血脂,包括三酰甘油(triglycerides,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C);
②肾功能,即尿素氮(blood urea nitrogen,BUN)、血肌酐(blood creatinine,Cr)、尿酸(uric acid,UA);
③糖化血红蛋白A1c(glycosylated hemoglobin A1c,HbA1c);
④口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),前1 d 停用胰岛素及胰岛素促泌剂并禁食12 h,分别测0、0.5、1、2、3 h 的血糖、胰岛素、C 肽和胰高血糖素;
⑤肾损伤蛋白系列,即单次UACR、24 h 尿白蛋白含量等指标。(3)绘制受试者工作特征曲线(receiver operating characteristic curve,ROC 曲线)计算C 肽/胰高血糖素、血糖、胰岛素、C 肽和胰高血糖素的曲线下面积(area under curve,AUC),即AUCC肽/胰高血糖素、AUC血糖、AUC胰岛素、AUCC肽、AUC胰高血糖素。AUC=15×空腹值+30×(0.5 h 值+3 h 值)+45×1 h 值+60×2 h。胰岛素抵抗指数(insulin resistance index,HOMA-IR)[8]=空腹血糖水平×空腹胰岛素水平/22.5。使用Cockcroft-Gault(C-G)[9]公式计算eGFR:男性=(140-年龄)×体质量(kg)×1.23/Cr(μmol/L)、女性=(140-年龄)×体质量(kg)×1.03/Cr(μmol/L)。肝肾功能、血脂等生化指标使用全自动生化分析仪检测(雅培c16000);
留取患者晨尿10 mL 检测UACR(URO-100 尿分析仪);
胰岛素及C 肽采用直接化学发光法测定;
胰高血糖素采用放射免疫法测定;
所有检测方法均严格按照说明书进行。
1.3 统计学方法 使用SPSS 19.0 软件包进行统计学分析,所有计量资料均行正态分布检验,符合正态分布的以表示,不符合正态分布的以中位数(四分位间距)[M(QL,QU)]表示,组间比较采用ANOVA分析,组间两两比较采用方差分析中的两两比较;
计数资料以%表示,各组间比较采用χ2检验,P<0.05 表示差异有统计学意义。采用多因素Logistic 回归模型分析与2 型糖尿病肾病相关的因素。
2.1 临床资料比较 3 组患者在病程、SBP、DBP、TC、LDL-C 及HbA1c 方面比较差异均有统计学意义(均P<0.05),且由B 组到AⅠ组,再到AⅡ组,均呈逐步升高的趋势,余临床资料差异均无统计学意义(均P>0.05)。3 组间两两比较可见,与B 组相比,AⅠ组的病程、SBP、DBP、TC、LDL-C、HbA1c 均显著升高(均P<0.05);
与AⅡ组相比,AⅠ组的年龄、病程、SBP、TC、LDL-C、HbA1c 均显著降低(均P<0.05),见表1。
表1 各组患者临床资料比较(n,%,)
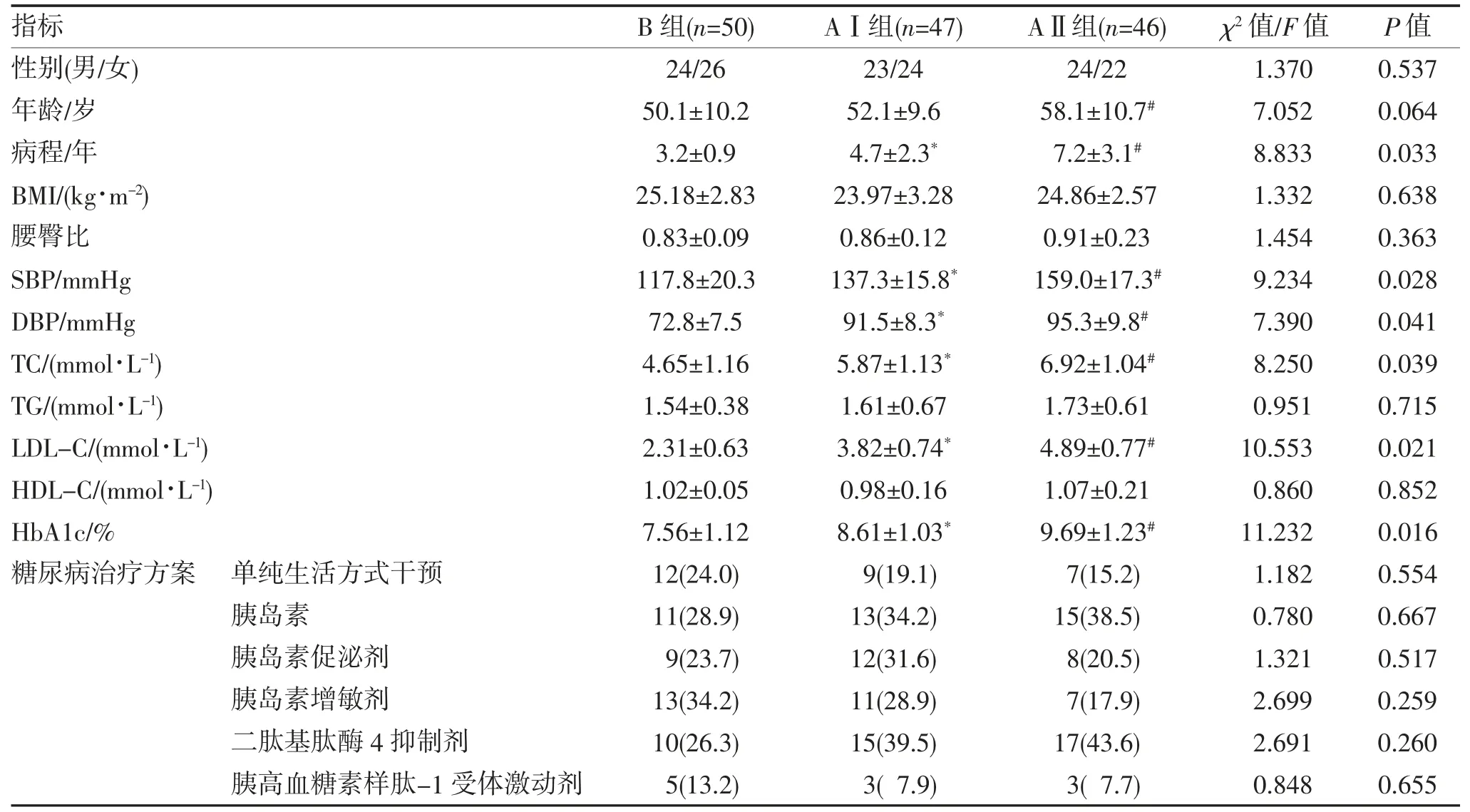
表1 各组患者临床资料比较(n,%,)
注:与B 组相比,*P<0.05;
与AⅠ组相比,#P<0.05。
2.2 肾损伤指标比较 3 组患者肾损伤指标比较差异均有统计学意义(均P<0.05)。与B 组相比,AⅠ组eGFR 呈下降趋势,UACR 呈上升趋势(均P<0.05);
而24 h 尿蛋白含量差异无统计学意义(P>0.05);
与AⅠ组相比,AⅡ组UACR 及24 h 尿蛋白含量呈逐步升高的趋势,eGFR 呈下降趋势(均P<0.05),见表2。
表2 各组患者肾损伤系列指标对比()

表2 各组患者肾损伤系列指标对比()
注:与B 组相比,*P<0.05;
与AⅠ组相比,#P<0.05。
2.3 HOMA-IR 及ROC 曲线相关指标比较 3 组患者OGTT 各项指标比较差异均有统计学意义(均P<0.05)。进一步组间两两比较可见,与B 组相比,AⅠ组血糖、胰高血糖素与HOMA-IR 明显升高(均P<0.05),C 肽、胰岛素和C 肽/胰高血糖素比值显著降低(均P<0.05);
与AⅡ组相比,AⅠ组血糖、胰高血糖素与HOMA-IR 明显降低(均P<0.05);
C 肽、胰岛素和C 肽/胰高血糖素比值显著升高(均P<0.05),见表3、图1。
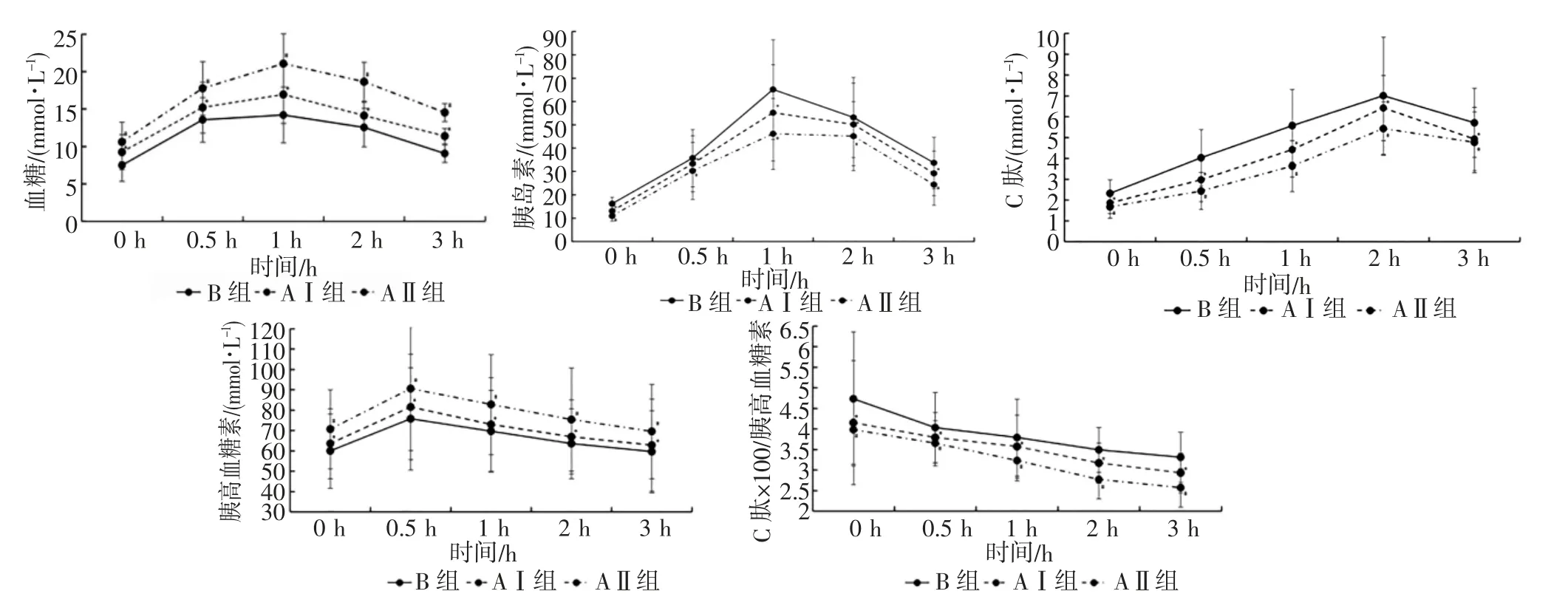
图1 患者OGTT 试验指标结果
表3 各组患者HOMA-IR 及ROC 曲线相关指标比较()

表3 各组患者HOMA-IR 及ROC 曲线相关指标比较()
注:与B 组相比,*P<0.05;
与AⅠ组相比,#P<0.05。
2.4 多因素Logistic 回归模型分析与2 型糖尿病肾病相关的因素 由以上结果筛选出变量:AUC血糖、AUC胰岛素、AUCC肽、AUC胰高血糖素、AUCC肽/胰高血糖素、HOMA-IR,以及一般临床资料中对糖尿病肾病有影响的变量:病程、SBP、DBP、TC、LDL-C、HbA1c,进一步行多因素Logistic 回归模型分析,可见AUC血糖、AUC胰高血糖素、HOMA-IR、病程、SBP、LDL-C、HbA1c与糖尿病肾病的发生呈正相关,AUCC肽、AUC胰岛素、AUCC肽/胰高血糖素与糖尿病肾病的发生呈负相关(均P<0.05),DBP、TC 与糖尿病肾病的发生无明显相关性,见表4。

表4 多因素Logistic 回归模型分析结果
目前关于糖尿病肾病的发病机制尚未完全明确,但有研究[10-11]认为血脂、血糖、血压等指标可作为糖尿病肾病预后判断的重要依据,且针对这些因素予积极控制,对于控制疾病的进展和改善预后有积极意义。
本研究发现,AⅠ组的病程、血压、TC、TG 均显著高于B 组,而年龄、病程和SBP 又低于AⅡ组,提示糖尿病病程、血压、血脂与糖尿病肾病的发生和发展密切相关。病程越长,血管内皮受血糖、血压和血脂的刺激越重,糖尿病肾病越容易发生和进展;
高血压可导致系膜细胞血管紧张素Ⅱ的合成增多,引起肾素-血管紧张素-醛固酮系统激活;
血脂黏附血管内皮可致微血管狭窄、闭塞,使肾小球系膜细胞移动和收缩功能损伤致eGFR 升高。
J.H.YOO 等[12-14]研究表明血糖控制是否达标与2型糖尿病肾病的发生密切相关,特别是对于葡萄糖达标时间<40%的患者,发生2 型糖尿病肾病风险更高。其机制可能为:高血糖通过非酶途径产生的晚期非酶糖基化终产物的积聚、蛋白激酶C 激活、多元醇通路、氧化应激加速、血管活性物质及细胞因子激活、激肽释放酶-激肽系统作用、管-球反馈机制等因素引起的组织损伤,各因素间相互作用,共同参与糖尿病肾病的发生发展。
本研究单因素分析结果发现血糖、胰岛素、C肽、胰高血糖素、C 肽/胰高血糖素、HOMA-IR 及病程、SBP、DBP、TC、LDL-C、HbA1c 与糖尿病肾病的发生密切相关。进一步行多因素Logistic 回归分析,发现AUC血糖、AUC胰高血糖素、HOMA-IR、病程、SBP、LDL-C、HbA1c 与糖尿病肾病的发生呈正相关;
而AUCC肽、AUC胰岛素、AUCC肽/胰高血糖素呈负相关。结果显示,病程、高血糖、高血压、高血脂、胰岛素抵抗、高胰高血糖素血症为糖尿病肾病发生和发展的危险因素,故积极有效的控制血糖、血压、血脂、调整胰岛α细胞的功能有效控制糖尿病肾病的发生和发展。
目前很多研究都集中在胰岛β 细胞与糖尿病肾病方面,糖尿病肾病不仅与胰岛β 细胞功能不全导致的高血糖有关,还与C 肽分泌水平有关,C 肽与很多糖尿病肾病的结构和功能异常密切相关。如可使内皮细胞一氧化氮和酶水平升高,可减轻肾小球高灌注高滤过,可降低肾小球系膜扩张等,而关于胰岛α 细胞与糖尿病肾病的研究较少。近年来已证实调整胰岛α 细胞分泌胰高血糖素样肽-1 的相关药物如肠高血糖素样肽1(glucagon like peptide-1,GLP-1)受体激动剂和二肽基肽酶Ⅳ(dipeptidyl peptidase Ⅳ,DPP-4)抑制剂与糖尿病合并慢性肾脏病患者关系密切。J.F.E.MANN 等[15]在SUSTAⅠN 研究中发现,GLP-1 受体激动剂索马鲁肽在治疗16 周后即可持续降低2 型糖尿病患者的蛋白尿,降幅均可达到50%。2019 年J.ROSENSTOCK 等[16]发现DPP-4 抑制剂利格列汀虽不能降低肾脏结局终点事件的发生,但可延缓患者蛋白尿的发生和发展。本研究进一步证实了在2 型糖尿病患者中胰岛α 细胞与2 型糖尿病肾病关系密切。但未发现不同组别间使用降糖药物的区别,而发现在AⅡ组中使用DPP-4 抑制剂的比例更高,提示越来越多的医务工作者能按照指南规范治疗糖尿病肾病。
但本研究样本量偏少,且对于有些指标如胰岛α 细胞功能,主要是通过测定一些生化指标的水平进行评估,缺少更全面更直观评估胰岛α 细胞功能的指标。未来将通过更多样本的前瞻性研究,进一步探讨与糖尿病肾病发生发展密切相关的影响因素。
猜你喜欢高血糖素胰岛病程临床胰岛制备研究进展医学信息(2022年9期)2022-11-27胰高血糖素样肽1及其受体激动剂在支气管哮喘治疗中的研究进展国际呼吸杂志(2019年22期)2019-12-092型糖尿病应用胰高血糖素样肽-1受体激动剂治疗的效果探讨中国卫生标准管理(2015年18期)2016-01-20中西医结合治疗对急性胰腺炎病程的影响中国卫生标准管理(2015年13期)2016-01-15手术科室用血病程记录缺陷评析中国卫生标准管理(2015年25期)2016-01-14空腹及糖负荷后胰高血糖素水平与代谢综合征的相关性研究成都医学院学报(2015年3期)2015-12-06家兔胰岛分离纯化方法的改进肝胆胰外科杂志(2015年1期)2015-02-27高频超声评价糖尿病膝关节病变与病程的关系卫生职业教育(2014年12期)2014-05-16非编码RNA在胰岛发育和胰岛功能中的作用中国医学科学院学报(2014年6期)2014-03-11胰高血糖素样肽-1类似物治疗2型糖尿病的研究进展中华老年多器官疾病杂志(2014年5期)2014-01-21扩展阅读文章
推荐阅读文章
老骥秘书网 https://www.round-online.com
Copyright © 2002-2018 . 老骥秘书网 版权所有