苏比努尔·买买提艾力,张 雯,李晓强,乔 彤
南京大学医学院附属鼓楼医院 1血管外科 2医学影像科,南京 210008
颈动脉狭窄(carotid artery stenosis,CAS)是常见的血管性疾病,占缺血性脑卒中病因的15%~20%[1]。除可增加卒中风险,CAS患者常出现不同程度的认知功能下降。然而,CAS相关的轻度认知功能障碍(mild cognitive impairment,MCI)在临床上较少受到关注,无明显脑缺血症状的CAS患者尽管记忆力、执行力等认知功能的改变已经对其生活带来影响,但这些变化依旧容易被轻视或忽视。研究表明有血管性认知功能障碍的患者中,有一半患者会在5年内逐渐进展为全面型认知功能受损,即痴呆[2]。因此,如果存在认知障碍,这些患者应该被认为是有症状的。越来越多的研究已经证实CAS相关认知功能障碍可能与脑结构和功能连接变化有关[3-4]。海马与认知功能密切相关,已有研究证实CAS时海马体积萎缩[5],但目前尚无研究证实CAS患者脑功能连接受损与海马及亚区体积变化之间的相关性。本研究拟通过对CAS患者认知功能、海马及亚区体积变化、海马至全脑功能连接变化进行评估,探究CAS患者发生认知功能障碍时海马及亚区体积变化与特定脑区功能连接异常之间的相关性,为进一步探索CAS相关认知功能下降机制提供可能的解释。
资料来源收集2019年1至12月在南京大学医学院附属鼓楼医院就诊并接受治疗的40例CAS患者,所有入组被试者均经过颈动脉超声或颈动脉CT血管造影检查,狭窄程度参考北美症状性颈动脉内膜切除术试验协作组标准。CAS患者入排标准根据本课题组既往研究入排标准[5]制定,具体纳入标准:(1)年龄50~90岁[6-7],性别不限;
(2)颈动脉B超检查证实颈内动脉狭窄;
(3)就诊期间完成头颅MRI检查;
(4)伴或不伴头晕、记忆力减退等症状;
(5)简易精神状态量表(mini-mental state examination,MMSE)和蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)初筛未达到痴呆程度。排除标准:(1)年龄<50岁或>90岁;
(2)6个月内卒中病史;
(3)血管性痴呆、帕金森病、癫痫、占位、中枢神经系统感染及其他引起认知下降的神经系统疾病;
(4)严重抑郁症、精神分裂症等精神心理疾病患者;
(5)严重的系统性疾病和代谢障碍疾病;
(6)药物、酒精成瘾病史;
(7)磁共振不能耐受或不能配合完成心理学测试;
(8)其他可能影响认知功能的疾病。同时招募31名健康对照,入组标准为:颈动脉超声检查未发现CAS;
既往无短暂的脑缺血或卒中发作;
能够配合完成所有量表测试;
MMSE、MoCA量表初筛未达到痴呆程度;
右利手;
没有磁共振扫描的禁忌证。排除标准与入组的CAS患者一致。所有入组对象知晓本研究方案,愿意参加本研究,并签署该课题研究的知情同意书。本研究涉及的所有程序均经南京大学附属鼓楼医院伦理委员会批准(批准号:2021-368-02)。
临床数据收集收集患者的临床资料,包括年龄、性别、受教育年限、血管危险因素(高血压、糖尿病、吸烟、喝酒、卒中史)、实验室检查(甘油三酯、总胆固醇、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、载脂蛋白A1、载脂蛋白B)。
认知测试采用MMSE和MoCA对两组人群进行认知评估。当受教育年限≤12年时MoCA最终得分加1分。测试总分30分,MoCA得分<26分认为存在认知功能减退[6]。
头颅MRI采用3.0T磁共振成像扫描仪(Achieva TX,Philips,Eindhoven,Netherlands),8通道头线圈进行扫描。采用高分辨三维加速场回波T1加权成像获得全脑结构图像。扫描参数:重复时间=9.9 ms,回波时间=4.6 ms,翻转角=8°,分辨率=1 mm×1 mm×1 mm,视野=256 mm×256 mm。海绵固定受试者头部,橡胶耳塞塞耳,并嘱其尽可能保持头部不动。使用FreeSurfer V6.0软件对脑结构进行分割和体积提取,双侧海马根据软件内置模板被分割为11个亚区结构,分别是海马头、海马体、海马尾、海马角(CA1、CA2/3、CA4)、齿状回(颗粒层、分子层)、下托、前下托和旁下托。
静息态功能磁共振分析数据预处理采用基于英国伦敦大学学院神经影像数据处理分析软件SPM的DPABI工具包(http://rfmri.org/dpabi)进行预处理。预处理流程包括:(1)时间层校正; 基于种子点的功能连接分析:采用基于种子点的功能连接计算方式,以结构MRI中体积组间差异有统计学意义的脑区海马为种子点,分别计算双侧的海马与全脑的功能连接,步骤包括:提取种子点内血氧依赖信号的平均时间序列,计算该时间序列与全脑内其他体素时间序列的相关性,最终得到全脑的功能连接图。相关系数进行 Fisher r-to-z 转换以标准化。 使用DPABI软件对各组的静息态功能磁共振功能连接脑图进行统计,使用独立样本t检验分析组间差异。多重比较校正使用高斯随机场理论进行,团块水平的校正阈值为P<0.05,体素水平的校正阈值为P<0.01。最后使用AFNI软件对结果进行可视化。样本量计算采用Gpower 3.1软件进行事后效能分析,海马体积在α误差为0.05时有足够的效能检测到组间差异(效应量d=0.69,效能=0.82)。 临床特征和认知评估两组人群年龄分布、受教育年限差异均无统计学意义(P均>0.05); 表1 入组被试者的一般资料、实验室检查及神经心理学评估结果 海马及亚区体积变化与认知功能的相关性CAS组双侧全海马体积较正常对照组显著缩小(右侧t=2.176,P=0.033; NC:正常对照; CA:海马锥体细胞区 将CAS组影像学数据和MMSE、MoCA评分进行偏相关分析,结果显示海马体积与MoCA及MMSE评分呈正相关(左侧全海马MoCA:r=0.289,P=0.015; 海马至全脑功能连接分析左侧海马至枕叶及额叶功能连接下降(表2、图3); L:左侧; L:左侧; 表2 海马至全脑功能连接差异团块 海马及亚区体积与差异团块功能连接z值的相关性提取差异团块的功能连接z值,与海马及亚区体积进行相关性分析,结果显示左侧全海马体积与右侧海马至颞叶的功能连接z值呈正相关(r=0.358,P=0.025),该相关性主要表现在海马头和海马体(海马头:r=0.360,P=0.024; aP<0.05,bP<0.01 认知评分与差异团块功能连接z值的相关性MoCA评分与右侧海马至额中回及前额叶功能连接z值呈正相关性(额中回:r=0.389,P=0.014; 本研究通过对比健康人群和CAS人群的神经精神量表结果、海马及亚区体积和基于海马的全脑功能连接变化,分析CAS患者认知评分、海马及亚区体积及海马至全脑功能连接之间的相关性,结果显示CAS患者总体认知评分较健康对照组显著降低(P<0.001)。控制协变量后进行组间分析,结果表明CAS患者认知评分下降仍具有显著意义(P<0.001)。这与既往研究[8-10]结论一致。 海马位于颞叶内侧深部,属于大脑边缘系统,与记忆、学习、认知等高级神经活动相关,尤其在短期记忆和空间记忆方面发挥重要作用。海马结构由海马角、齿状回、下托和围绕胼胝体的海马残体组成。海马角依据细胞形态和不同皮质发育差异以及纤维通路的不同可分为CA1~CA4,齿状回由3层细胞排列成U形,分别为分子层、颗粒层和多形层。CA4即为齿状回的多形层[11-13]。海马与抑郁症、阿尔茨海默病、痴呆等神经系统疾病密切相关,海马萎缩是诊断痴呆的一个敏感指标,在MCI时即可观察到海马萎缩。已有研究表明在MCI和阿尔茨海默病早期可以观察到海马体积缩小[14-15]。本研究主要着眼于CA1~CA4、颗粒层、分子层、下托、前下托及旁下托的结构变化,同时讨论海马头、体、尾及全海马体积的变化及其与全脑的功能连接变化。 本研究显示CAS患者全海马体积较健康人群显著下降,海马体积的萎缩主要表现在海马体和海马尾体积缩小,而海马头体积下降无统计学意义。CAS患者各海马亚区体积也呈下降趋势,但仅双侧分子层和下托、左侧CA4、左侧颗粒层和左侧前下托体积的下降有统计学意义。笔者认为CAS时各海马亚区体积存在不同程度的萎缩,但由于本研究样本量较小,某些亚区组间对比仅表现下降趋势但差异无统计学意义。此外,本研究显示旁下托体积呈增加趋势,笔者猜测这可能与代偿有关。 海马下托在记忆形成和提取中扮演重要角色[12],本研究显示CAS患者中双侧下托及前下托与MoCA及MMSE评分呈正相关,表明MoCA和MMSE评分可能作为CAS患者记忆形成和提取功能受损的简单筛查指标; 大脑的认知活动并不是局限于某一个区域,而是多个区域组成的大脑网络[16-17]。本研究显示CAS患者较正常对照出现左侧海马至枕叶和额叶的功能连接下降,右侧海马至枕叶、颞叶、前额叶和额中回的功能连接减低。海马是记忆形成和储存的核心脑区,记忆信息在海马体中通过不同亚区的几种平行途径进行处理。在经典的记忆传递三突触通路中,信息从内嗅皮层到齿状回再到CA3,然后到海马CA1进行输出[18]。CA1区神经元也直接接受来自穿通纤维的输入并传到下托,这些神经元反过来将主要的海马输出发回内嗅皮层,形成一个环路[19]。前额叶皮质参与包括工作记忆、灵活性、决策和奖赏性学习等多种认知功能,从海马直接或间接投射到海马-前额叶皮质回路的神经元在认知和情绪调节以及记忆巩固中发挥关键作用[20]。后扣带回皮质和楔前叶加外侧顶叶皮质,与两个海马相连,形成海马-顶叶记忆网络,参与对既往经验的回忆。额顶叶网络涉及外侧前额叶和后顶叶皮质的部分,被认为是认知控制的枢纽,与流体智力密切相关。不同研究显示,这些网络的失调与在患者中观察到的认知障碍相关[21],阿尔茨海默病中也观察到左侧海马功能网络中双侧枕中回、右侧海马功能网络中右侧额中回和右中央前回功能连接降低[22],本研究也观察到这些网络类似的失调,这与既往研究结果一致。 分析全脑功能连接差异团块与海马体积变化的相关性显示,多数海马亚区体积与右侧海马至颞叶的功能连接z值呈正相关。海马为颞叶重要结构之一,海马体积的萎缩可能导致海马至颞叶功能连接下降,其最终表现形式之一可能为MCI。在海马结构与双侧海马至枕叶及额叶的功能连接相关性分析中观察到一些呈负相关,笔者认为这可能是一种代偿的结果,尽管这些数据未表现出显著的相关性,但其他一些针对MCI患者的研究得出了类似的代偿结果[23-27]。 本研究显示MoCA评分与右侧海马至前额叶和额中回功能连接z值存在相关性,MMSE评分仅表现为与右侧海马至前额叶功能连接z值呈正相关,表明MoCA量表在发现工作记忆等认知功能受损方面可能更为敏感。未来的研究中可以将此作为切入点,探究MoCA评分和MMSE评分是否可以作为预测海马功能连接下降的简易筛查指标并进一步验证其敏感性和准确性。 本研究有一定的局限性。首先,本研究仅将基线特征中有差异的脂代谢相关指标作为协变量进行控制,并未根据是否存在脂代谢异常将CAS患者进一步分组,因此无法避免脂代谢异常对海马结构和功能的影响; 综上,海马体、下托可能在CAS相关的早期轻微认知障碍中发挥作用。CAS患者海马至大脑皮层特定区域功能连接减低,海马体积改变在右侧海马至颞叶功能连接下降中发挥作用。MoCA和MMSE评分可能在一定程度上反映右侧海马至额叶的功能连接状态。这些结论表明CAS时发生认知功能受损的机制可能是由于海马结构萎缩、功能连接异常所致。
(2)头动校正(以平动<3 mm,转动<3°为排除标准);
(3)去线性漂移;
(4)配准并标准化到MNI空间;
(5)重采样,体素大小为3 mm×3 mm×3 mm;
(6)空间平滑(半峰全宽=4 mm×4 mm×4 mm);
(7)滤波,保留0.01 Hz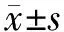
但CAS男性较女性多见(Z=4.024,P=0.045)。CAS组既往短暂性脑缺血发作或脑梗死患者构成比较正常对照组显著增高(Z=11.192,P=0.001),高血压及吸烟患者的构成比有增高趋势,但差异均无统计学意义(P均≥0.05)。CAS组甘油三酯水平显著高于正常对照组(χ2=2.475,P=0.013)、高密度脂蛋白胆固醇(χ2=-2.313,P=0.021)和载脂蛋白A1(χ2=-3.347,P=0.001)显著低于正常对照组,总胆固醇、低密度脂蛋白胆固醇、载脂蛋白B两组比较差异均无统计学意义(P均>0.05)。CAS组MMSE(F=13.346,P=0.001)和MoCA(F=52.005,P<0.001)评分较正常对照组显著降低(表1)。
左侧t=2.881,P=0.005),尤以左侧为甚。海马萎缩主要表现在海马体(右侧t=2.336,P=0.022;
左侧t=3.165,P=0.002)和海马尾(右侧t=2.394,P=0.019;
左侧t=3.158,P=0.002)体积萎缩,海马头(右侧t=1.709,P=0.092;
左侧t=1.955,P=0.054)体积差异无统计学意义(图1)。各海马亚区体积组间比较显示,CAS组患者各海马亚区体积呈缩小趋势,其中双侧分子层(右侧t=2.103,P=0.039;
左侧t=2.702,P=0.009)和下托(右侧t=2.211,P=0.030;
左侧t=2.430,P=0.018),左侧CA4(t=2.505,P=0.015)、颗粒层(t=2.448,P=0.020)和前下托体积(t=2.484,P=0.015)的差异有统计学意义,其余变化差异均无统计学意义(P均>0.05)(图2)。
CAS:颈动脉狭窄
右侧全海马MMSE:r=0.249,P=0.038;
左侧全海马MMSE:r=0.316,P=0.008);
海马体积与MoCA评分相关性主要表现在海马体和海马尾部(右侧海马体:r=0.303,P=0.011;
左侧海马体:r=0.354,P=0.003;
右侧海马尾:r=0.255,P=0.033;
左侧海马尾:r=0.356,P=0.002),海马体积与MMSE评分的相关性在海马头、体、尾部均有体现(左侧海马头:r=0.258,P=0.031;
右侧海马体:r=0.298,P=0.012;
左侧海马体:r=0.344,P=0.004;
左侧海马尾:r=0.265,P=0.027)。各海马亚区中双侧下托及前下托、左侧分子层体积变化与MoCA评分呈正相关(右侧下托:r=0.290,P=0.015;
左侧下托:r=0.382,P=0.001;
右侧前下托:r=0.293,P=0.014;
左侧前下托:r=0.440,P<0.001;
左侧分子层:r=0.259,P=0.031)。其余海马亚区体积变化与MoCA评分无相关性。双侧下托及前下托、左侧分子层体积变化与MMSE评分成正相关(右侧下托:r=0.278,P=0.020;
左侧下托:r=0.419,P<0.001;
右侧前下托:r=0.296,P=0.013;
左侧前下托:r=0.506,P<0.001;
左侧分子层:r=0.298,P=0.012)。其余影像学变化与MMSE评分无相关性。
右侧海马至枕叶、颞叶、额中回及前额叶的功能连接降低(表2、图4)。
R:右侧;
蓝色代表左侧海马至全脑功能连接值降低团块:枕叶、额叶,色条表示t值,所有结果P<0.05
R:右侧;
蓝色代表右侧海马至全脑功能连接值降低团块:枕叶、颞叶、额中回、前额叶,色条表示t值,所有结果P<0.05
海马体:r=0.391,P=0.024);
右侧全海马体积与右侧海马至颞叶功能连接z值虽无相关性(P>0.05),但海马头仍表现出显著相关性(r=0.325,P=0.044)。各海马亚区中,双侧CA1、右侧CA4、左侧分子层、右侧颗粒层与右侧海马至颞叶的功能连接z值呈正相关(右侧CA1:r=0.326,P=0.043;
左侧CA1:r=0.341,P=0.034;
右侧CA4:r=0.317,P=0.049;
左侧分子层:r=0.397,P=0.012;
右侧颗粒层:r=0.319,P=0.048)。此外,双侧前下托、右侧旁下托、左侧下托与右侧海马至枕叶功能连接z值呈正相关(右侧前下托:r=0.430,P=0.006;
左侧前下托:r=0.372,P=0.020;
右侧旁下托:r=0.370,P=0.021;
左侧下托:r=0.329,P=0.041);
右侧前下托与左侧海马至额中回功能连接z值呈正相关(r=0.334,P=0.038);
右侧下托与右侧海马至额中回功能连接z值呈正相关(r=0.324,P=0.044)(图5)。
前额叶:r=0.363,P=0.023);
MMSE评分与右侧海马至前额叶功能连接z值呈正相关(前额叶:r=0.321,P=0.046)。其余差异团块功能连接z值与认知评分无相关性。
而双侧全海马体积与认知量表评分相关性并不一致,笔者认为这与样本量较小有关,后续研究中将进一步验证该结论。
其次,本研究仅探讨了海马与全脑功能连接变化情况,未观察海马亚区与全脑功能连接的情况,无法将功能连接和结构变化的相关性确定到具体的某个海马亚区,未来研究可以某些关键的海马亚区为种子点分析全脑功能连接变化,确定具体的功能连接受损区域。此外,本研究的认知评分采用笼统的总体认知评分量表,因此只给出了差异团块功能连接z值与总体认知水平的相关性,对于特定方面的认知功能受损与功能连接异常的相关性分析不够。后续的实验可考虑使用联合量表测量不同认知领域的认知受损情况,如记忆评价工具:California词语学习测验、数字广度测试、韦氏逻辑记忆;
语言能力评价工具:词语流畅性、波士顿命名;
注意和执行评价工具[28-29]:连线测试、Stroop试验等,分析特定脑区功能连接变化与相对应的具体认知领域评分相关性,从而得到更加准确的结论。最后,本研究样本量较小且为横向研究,CAS发病率男性高于女性,尽管本研究将性别作为协变量进行了控制,依旧可能存在选择偏倚,未来需要继续扩大样本量并结合颈动脉内膜切除术改善患者脑血供后纵向随访评估患者海马及亚区体积和海马至全脑功能连接是否得到改善进一步验证本研究的结论。
扩展阅读文章
推荐阅读文章
老骥秘书网 https://www.round-online.com
Copyright © 2002-2018 . 老骥秘书网 版权所有